Скорость реакции – это важное качество для многих видов деятельности. Быстрая и точная реакция может помочь вам в спорте, автомобильной езде, работе или обычной повседневной жизни. Но как можно улучшить свою реакцию и стать еще более отзывчивым? В этой статье мы рассмотрим лучшие методы и упражнения, которые помогут вам увеличить свою скорость реакции и повысить эффективность вашей деятельности.
Одним из основных методов улучшения скорости реакции является тренировка глаз и мозга. Игры, которые требуют быстрой реакции на изменяющуюся ситуацию, могут быть отличным инструментом для такой тренировки. Такие игры помогают улучшить периферическое зрение, координацию движений и быстроту реакции.
Одной из популярных игр для тренировки скорости реакции является «Что изменилось?». Эта игра заключается в том, чтобы быстро определить изменения в изображении. Начните с простых упражнений, где изменения будут небольшими, а затем постепенно усложняйте задачу. С такой тренировкой ваш мозг и глаза будут работать быстрее и более точно.
Тест на Скорость Реакции, Или Как Быстро Работает Ваш Мозг
“Упражнения, которые требуют мгновенной реакции на определенные сигналы или звуки, также могут быть полезными для улучшения скорости реакции. Одним из таких упражнений является «Поймай мяч». В этой игре вам нужно мгновенно реагировать на звук сигнала и поймать мяч, который будет мелькать на экране. Это упражнение поможет развить вашу концентрацию, реакцию и быстроту движений.”
Почему быстрота реакции важна и как её увеличить
Зачем быстрота реакции важна?
Быстрая реакция может помочь нам во многих аспектах жизни. В спорте, большинство двигательных навыков, таких как реакция на изменение положения или движения, требуют хорошей скорости реакции. В работе, быстрая реакция может помочь принимать решения на основе новой информации и быстро реагировать на изменения внешней среды. В обучении, быстрота реакции позволяет быстро адаптироваться и усваивать новые знания.
Как увеличить скорость реакции?
Существует множество упражнений и методик, которые помогают увеличить скорость реакции:
- Упражнения на внимание и концентрацию: тренировка мозга для улучшения внимания и быстроты реакции.
- Упражнения на пространственное восприятие: тренировка способности быстро оценивать и анализировать пространственные ситуации.
- Упражнения на моторику: тренировка мышц и суставов для повышения быстроты и точности движений.
- Игры и спортивные тренировки: активные игры и тренировки, которые требуют быстрой реакции и реагирования на изменяющиеся условия.
Важно понимать, что увеличение скорости реакции – это постоянный процесс тренировок и практики. Регулярные упражнения и тренировки помогут улучшить мышечную и нервную систему, что в свою очередь приведет к увеличению быстроты реакции.
Реакция и успех: связь между ними
Когда мы владеем быстрой реакцией, мы способны адекватно реагировать на внешние факторы и принимать правильные решения в нужный момент. Это позволяет нам выигрывать в соревнованиях, достигать лучших результатов в работе и добиваться успеха во всех сферах жизни.
Упражнения на реакцию. Как увеличить реакцию?
Люди с хорошей реакцией лучше адаптируются к переменам и быстро находят выход из сложных ситуаций. Они способны быстро оценивать ситуацию, принимать информацию и принимать необходимые решения. Благодаря этому, их шансы на успех велики.
К счастью, реакцию можно тренировать. Ведь это – навык, который можно развивать и совершенствовать. Существует множество упражнений и методик, которые помогают улучшить реакцию и повысить вероятность достижения успеха.
Среди наиболее эффективных методов тренировки реакции можно выделить быстрые реакционные игры и физические тренировки для улучшения координации движений. Однако, важно понимать, что тренировка реакции требует времени и упорства. Регулярные тренировки позволяют укрепить нервную систему и улучшить реакцию на новые ситуации. В конечном итоге, это поможет достичь большего успеха в жизни.
Таким образом, реакция и успех тесно связаны между собой. Имея хорошо развитую реакцию, мы повышаем свои шансы на достижение поставленных целей и получение желаемых результатов. Тренировка реакции – это ключ к успеху и преодолению жизненных трудностей.
Источник: povagonke.ru
Какими способами можно увеличить или уменьшить скорость химической реакции?
Химическая реакция — это процесс превращения одних веществ в другие. Во время реакции происходят изменения в химических связях между атомами. Скорость химической реакции — это мера того, как быстро реагенты превращаются в продукты.
Существует несколько способов, которые позволяют увеличить или уменьшить скорость химической реакции:
1. Изменение концентрации реагентов
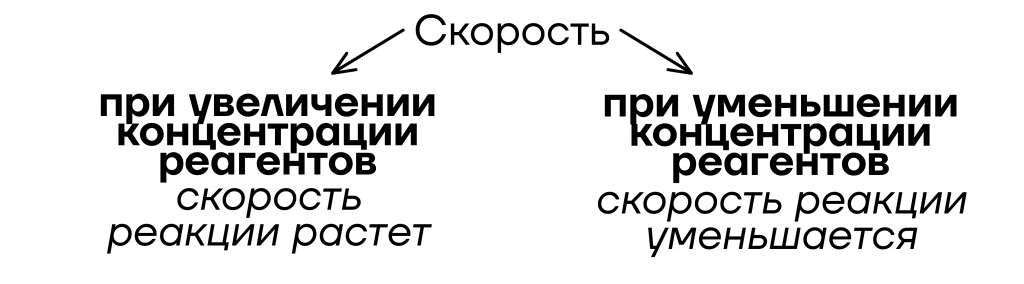
Первый способ изменить скорость химической реакции — изменить концентрацию реагентов. Повышение концентрации реагентов приводит к увеличению количества взаимодействующих частиц, что увеличивает вероятность столкновений и, следовательно, скорость реакции. Уменьшение концентрации реагентов, наоборот, уменьшает скорость реакции.
2. Изменение температуры
Температура также имеет значительное влияние на скорость химической реакции. Повышение температуры обычно приводит к увеличению кинетической энергии молекул, что способствует более частым и энергичным столкновениям между частицами и, как следствие, увеличивает скорость реакции. Уменьшение температуры, напротив, снижает скорость реакции.
3. Использование катализаторов
Катализаторы — это вещества, которые ускоряют химическую реакцию, не участвуя в ней. Катализаторы повышают скорость реакции, предоставляя альтернативные пути для прохождения реакции с более низкой активационной энергией. После реакции катализатор остается неизменным, поэтому может использоваться многократно.
4. Изменение поверхности вещества
Увеличение поверхности вещества, вступающего в реакцию, позволяет увеличить скорость реакции. Примером может служить мелко размолотый порошок вместо больших кусков, а также использование каталитических материалов с большой площадью поверхности.
5. Изменение давления (только для газовых реакций)
Для реакций, в которых газы являются реагентами или продуктами, изменение давления может повлиять на скорость реакции. Повышение давления увеличивает концентрацию газовых молекул, что ведет к увеличению частоты столкновений и, как следствие, к повышению скорости реакции.
В заключение, скорость химической реакции можно изменить, изменяя концентрацию реагентов, температуру, используя катализаторы, изменяя поверхность вещества или давление (для газовых реакций). Понимание этих способов позволяет управлять химическими процессами в лаборатории и промышленности.
- Здравствуйте, проблема в том что я потерял справку из вуза для военкомата, что делать?
- А давайте и меня поженим. А то меня давненько замуж не зовут (((
- Футболисты с фамилией Love: есть ли ещё кто-то, кроме Вагнера Лава?
- Ту-154: почему эти самолеты до сих пор летают и сколько их осталось в авиапарке?
- Кого больше, верующих или «типа верующих»?
- Умру ли я сейчас?
- К чему? +++вн.
- Помогите найти японский детский фильм про НЛО
Источник: irobot-spb.ru
Скорость химической реакции
Вещества, как и люди, могут передвигаться пешком, а могут ездить на такси. О том, как это происходит, расскажем в этой статье.
На этой странице вы узнаете
- Катализатор – ваш лучший друг?
- Что общего у реагентов и продавцов-консультантов из магазина одежды?
- Можно ли пантеру превратить в черепаху?
Химические реакции на ускорении
Скорость химической реакции – быстрота её протекания. То есть она показывает, насколько быстро расходуются реагенты и образуются продукты.
Важно понять, от чего может зависеть скорость химической реакции. Есть шесть основных факторов:
- наличие катализатора,
- температура,
- концентрация реагентов,
- давление,
- площадь соприкосновения реагентов,
- природа реагентов.
От чего зависит скорость реакции
- От наличия катализатора (k)
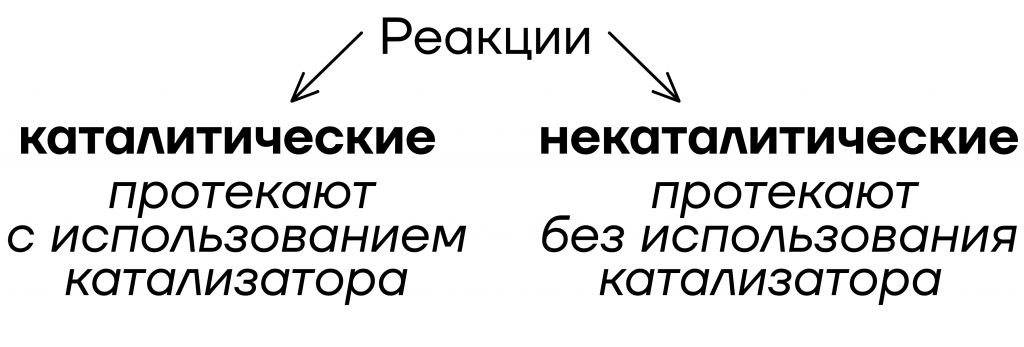
Всё понятно, кроме одного: что же такое катализатор?
Катализатор – вещество, которое ускоряет реакцию, но не расходуется в процессе.
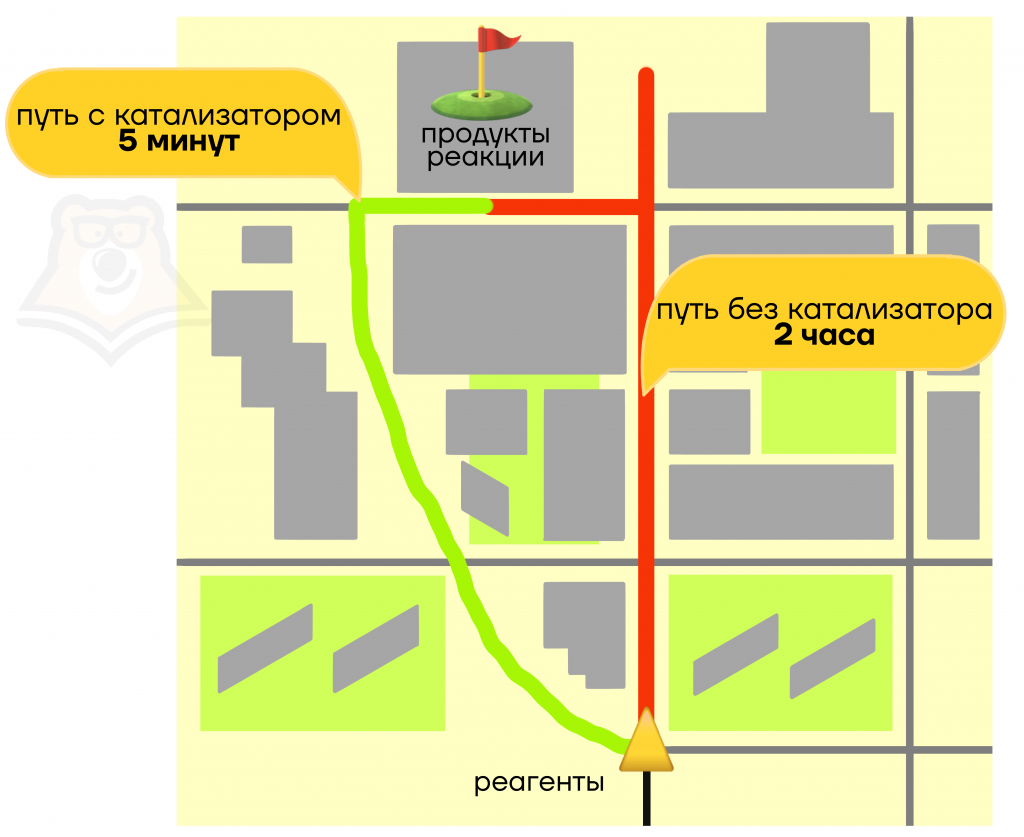
У катализатора есть своя реакция, которую он вызывает. Каталитическая реакция – это реакция которая протекает быстрее обычной за счет использования катализатора.
Если перевести это на человеческий язык, то люди пешком (без катализатора) идут медленнее, чем едут на такси (с катализатором).
У катализатора есть двойник с абсолютно обратными характеристиками – ингибитор. Раз катализатор увеличивает скорость реакции, значит, ингибитор будет её уменьшать.
- От температуры (t)

Важно понимать, что молекулы/частицы при нагревании начинают быстрее двигаться и чаще сталкиваться.
Представим, что мы лежим на пляже. Если погода облачная, то нам тепло, а если погода ясная, нам становится жарче (увеличивается температура тела), и тем быстрее мы загораем или обгораем (скорость реакции увеличивается).
Уточнение: только для жидкостей и газов
| Важно! Понятие концентрации распространяется только на газы и жидкости, то есть добавление твердого вещества обычно не влияет на скорость реакции. |
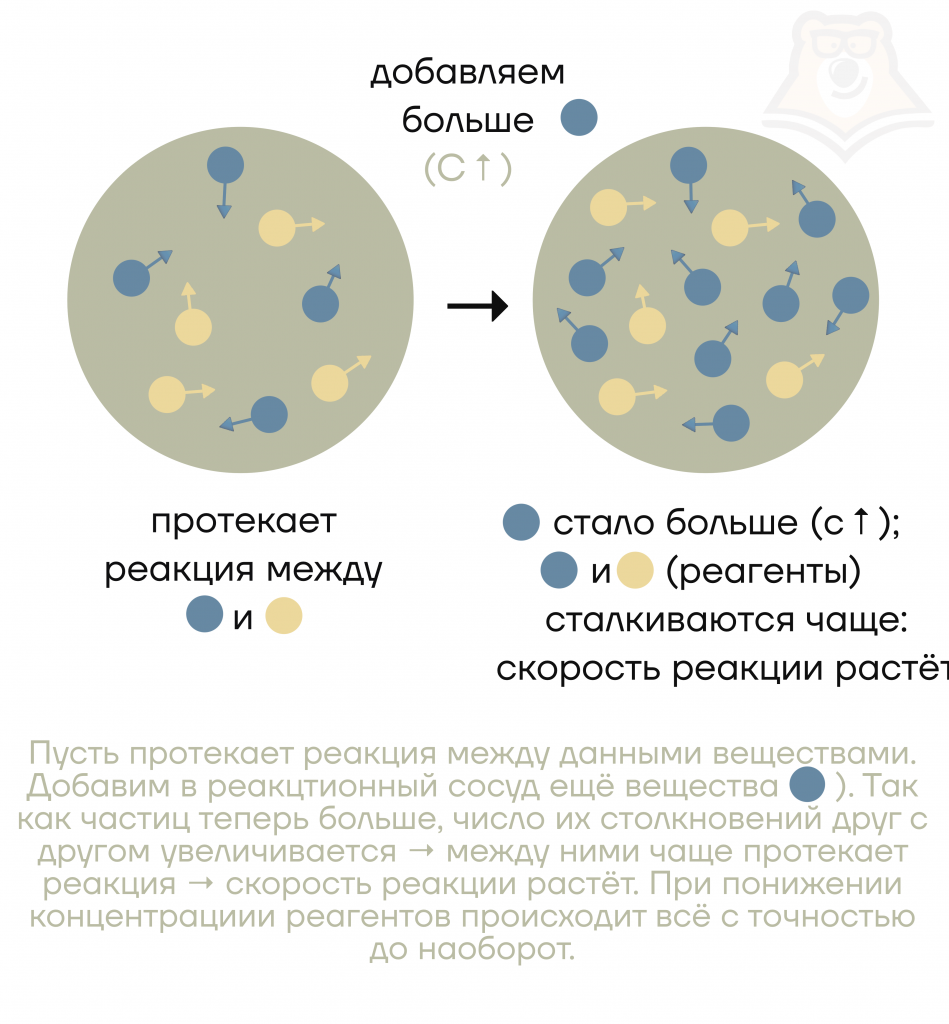
Почему добавление твердого вещества чаще всего не влияет на скорость реакции?
Потому что при добавлении твердого вещества увеличение концентрации реагента не произойдет. А без реагентов реакция не захочет разогнаться и скорость останется неизменной.
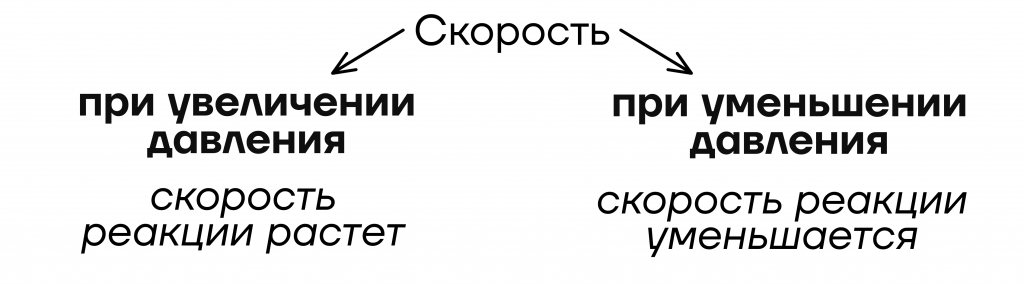
Уточнение: только для газов
| Важно! Так как газы – это единственные по агрегатному состоянию вещества, которые способны распределяться по всему объему реакционного сосуда, то изменение давления будет влиять только на них. |
Значит, если в реагентах есть хотя бы один газ – изменение давления будет влиять на скорость реакции.
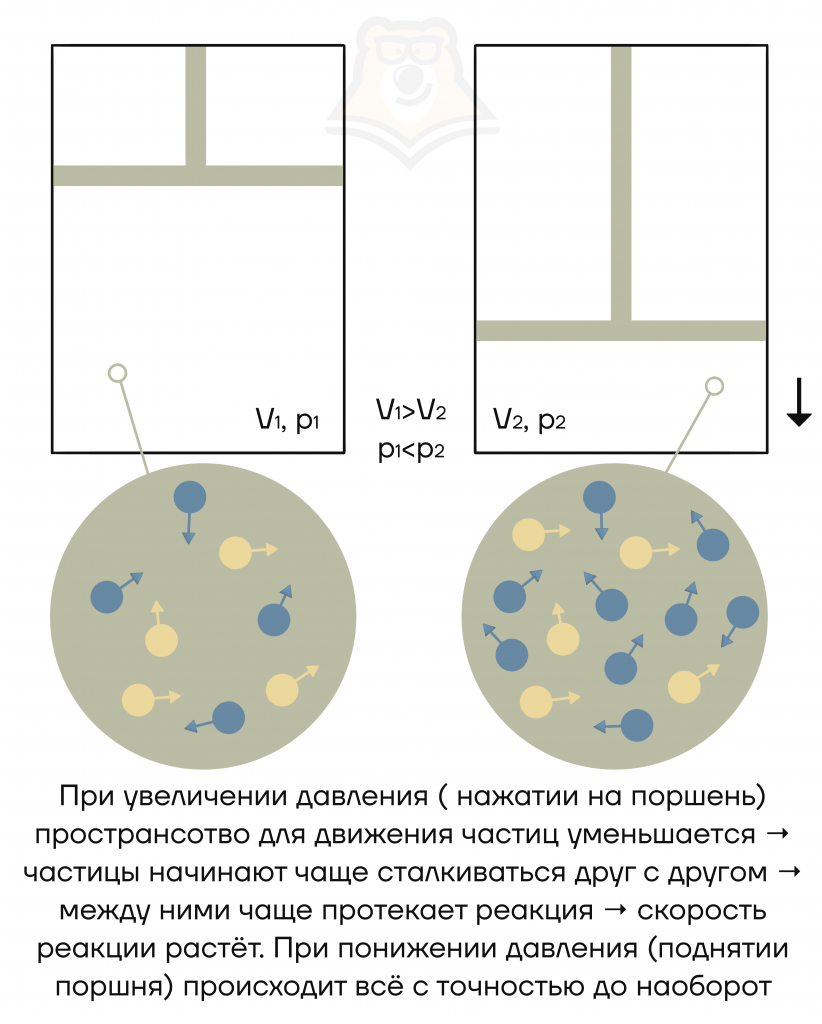
Как связаны между собой давление и объем?
Это две противоположные величины:
- увеличение давления = уменьшение объема;
- уменьшение давления = увеличение объема.
Как это запомнить? Специально для этого мы приготовили простую картинку. Просто уделите ей минутку внимания, и всё уложится в голове.
- От площади соприкосновения реагентов = степени измельчения
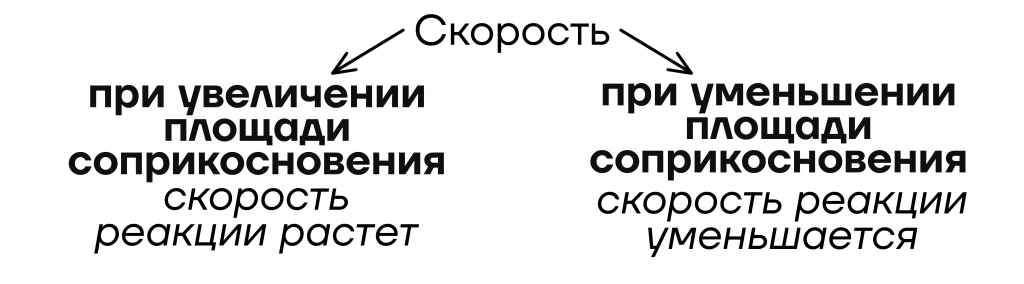
Уточнение: только если в реагентах есть хотя бы одно твердое вещество
Давайте наглядно посмотрим на реакцию между цинком и соляной кислотой. В первом стакане будет протекать медленнее, чем во втором.
Перемешивание веществ тоже увеличит скорость реакции за счет увеличения скорости соприкосновения веществ.
Чтобы это понять, достаточно представить чай. Если туда добавить ложку сахара и не перемешивать его, равномерное распределение сахара по стакану будет происходить очень медленно. Однако если размешать его ложкой, то скорость возрастет!
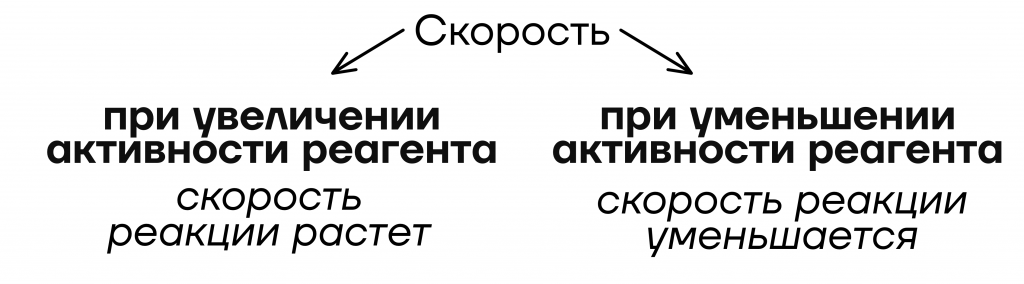
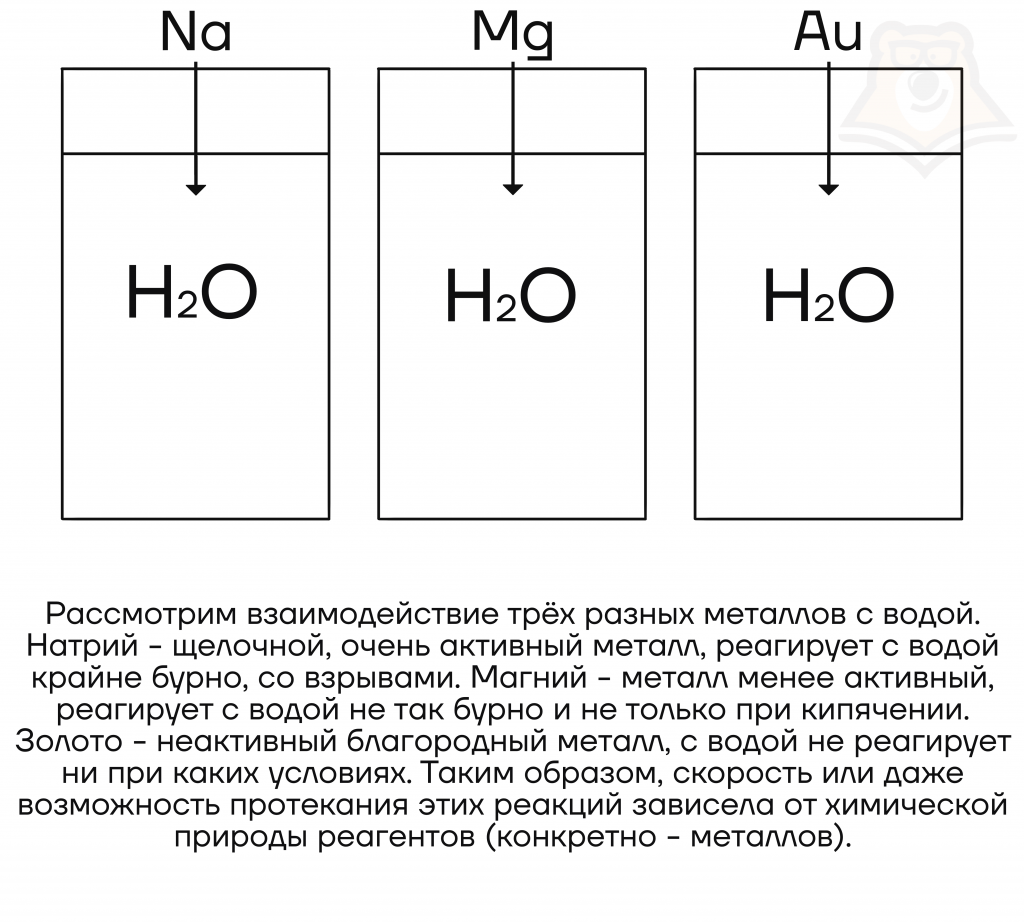
При реакции воды с металлами скорость реакции уменьшается с уменьшением активности металла. То есть активнее всего с водой будут реагировать именно щелочные металлы.
У людей всё также. Скорость поиска друзей или работы зависит от активности человека. Чем более активный человек, тем быстрее он достигнет цели.
Еще нужно помнить, что быстрее всего протекают реакции между газами и между растворами.
| А можно ли пантеру превратить в черепаху при помощи химии?
Можно, и это даже не магия. Для этого всего лишь нужно замедлить скорость реакции. Это можно сделать путем добавления ингибитора, уменьшения температуры, концентрации реагентов, давления, площади соприкосновения веществ, а также снижения активности реагентов. |
Фактчек
- Скорость химической реакции – быстрота её протекания. То есть она показывает, насколько быстро расходуются реагенты и образуются продукты.
- Скорость абсолютно всех реакций зависит от температуры и от природы реагентов.
- Скорость некоторых реакций зависит ещё от нескольких факторов:
- газы зависят от давления и объема реакционного сосуда;
- катализатор применим только для каталитических реакций;
- концентрация вещества влияет чаще всего только на жидкости и газы;
- площадь соприкосновения реагентов – только на те реакции, где есть хотя бы один твердый реагент.
Проверь себя
Задание 1.
Что произойдет со скоростью реакции при увеличении концентрации водорода в следующей реакции: H2 + Cl2 = 2HCl
- Увеличится
- Уменьшится
- Не изменится
Задание 2.
Какой фактор не влияет на скорость реакции: 6Li +N2 = 2Li3N
- Давление
- Добавление катализатора
- Температура
- Площадь поверхности соприкосновения веществ
Задание 3.
Какой фактор влияет на скорость реакции: NaOH + HCl = NaCl + H2O
- Давление
- Разбавление смеси водой
- Добавление катализатора
- Площадь поверхности соприкосновения веществ
Ответы: 1. — 1; 2. — 2; 3. — 2.
Источник: umschool.net
